基因组编辑产品
常见问题
能:能。对于这种基因组编辑操作,您需要带有靶点同源重组臂以及所需点突变的供体 DNA。供体 DNA 可以是一个质粒或一条单链的寡聚核苷酸。供体 DNA 需要与基因组编辑工具(TALEN 或 CRISPR)进行共转染。基因组编辑工具在靶点生成的 DNA 双链断裂(DSB),细胞在存在供体 DNA 的情况下,会将供体 DNA 作为修复模板,利用同源重组(HR)机制修复 DSB。
易锦提供供体质粒设计及构建服务。我们能构建带有目的修饰及靶序列同源重组臂的供体质粒。质粒同时会敲入筛选标记(如嘌呤霉素抗性基因)或 copGFP 报告基因。这些筛选标记两端可带有 loxP 重组位点,可以在需要时通过 Cre-loxP 重组从基因组上去掉筛选标记序列。使用易锦提供的供体质粒,能减少筛选的克隆数,方便挑出所需的修饰阳性细胞系。
答:用同源重组(HR)方法做基因组编辑有几大理由:1)HR诱导的基因组编辑具有精确性和可控性,可以实现几乎任意基因序列操作;2)您可以通过同时敲入筛选标记(如抗性基因或荧光报告基因),大大提高筛选阳性克隆的简便性。
易锦提供供体质粒设计及构建服务。我们能构建带有目的修饰及靶序列同源重组臂的供体质粒。质粒同时会敲入筛选标记(如嘌呤霉素抗性基因)或 copGFP 报告基因。这些筛选标记两端可带有 loxP 重组位点,可以在需要时通过 Cre-loxP 重组从基因组上去掉筛选标记序列。使用易锦提供的供体质粒,能减少筛选的克隆数,方便挑出所需的修饰阳性细胞系。
答:是的。DNA 双链断裂(DSB)发生时供体 DNA 必须同时存在于细胞内才会被用作同源重组(HR)模板。 否则,细胞会用非同源末端链接(NHEJ)修复 DSB。
答:我们的 TAL 效应子和 CRISPR 质粒通常是不会在转染实验后整合到宿主基因组里的。不过我们仍建议客户在筛选到单克隆细胞系后再在其中筛选质粒已经丢失的细胞系。您可以测试细胞系是否对质粒所含的抗性敏感,或观察细胞系是否还在表达质粒的荧光报告基因。此外,我们的慢病毒型克隆在包装慢病毒颗粒后能整合到基因组,但整合位点是随机的。
答:CMV 或 EF1a 启动子使得表达质粒 DNA 成为可能。我们建议您用对您的细胞系来说效率最高的方法。以下是一些方法,可以用于将我们的基因组编辑工具导入到细胞里:
1. 标准转染
2. 电击转染.
3. 慢病毒转导
4. DNA 或 mRNA 显微注射。这种质粒需要含有 T7 启动子,以便进行体外转录生成 mRNA。
答:如果您要在不使用同源供体的情况下用 TALEN 或 CRISPR 生成突变,就需要进行更耗时间精力的下游实验来鉴别修饰成功的克隆。在转染后,您需要尽可能多分离单克隆细胞系。之后的筛选步骤取决于修饰的本身,具体介绍如下:
1. 如果您是在引入插入或缺失,并且插入缺失的大小足以通过标准的琼脂糖凝胶电泳进行分辨,那最简单的方法是用引物扩增靶点序列来进行筛选。
2. 对于较小的插入缺失,您可以通过 T7 核酸内切酶 I 检测筛选克隆。这种检测方法能通过剪切错配的双链 DNA 检测序列突变。易锦提供 IndelCheck™ CRISPR/TALEN 插入缺失检测检测体系以及靶点 PCR 引物定制服务。另外您也可以用 real-time PCR 方法进行筛选。
3. 如果您需要引入一个点突变,您可以选择 Surveyor 检测(另一种错配酶切检测方法)或 real-time PCR 检测序列修饰。
4. 加入您引入的修饰会生成或破坏一个限制性内切酶位点,则可以通过酶切 PCR 产物的方法分辨修饰成功与未被修饰的等位基因。
5. 最后,可以采用桑格测序法测 PCR 产物,或使用二代测序法对全基因组进行测序来检测突变修饰。不管选择采用哪种测序方法,您都需要确认是部分还是全部等为基因都被修饰。
为了节省花在检测修饰阳性克隆上的时间和经历,易锦推荐您使用我们的供体克隆设计构建服务。我们会构建含有客户所需修饰、靶序列区同源重组臂以及筛选标记和报告基因等元件的供体质粒。筛选标记及报告基因两端可带有 LoxP 重组位点,可以通过 Cre 蛋白介导重组反应在需要的时候去除这些序列。使用易锦提供的供体质粒能方便筛选修饰阳性的克隆,减少需要进行检测的克隆数目。
答:对 safe harbor 整合,我们推荐使用引物对重组位点进行 PCR 扩增,或使用 Southern blotting 排除随机整合。所有的 GeneCopoeia Safe Harbor 基因敲入试剂盒都包含有这个验证 PCR 的引物组合。对于其他利用 HR 机制的基因编辑实验,可以使用 PCR 辨别编辑位点。PCR 方法可以显示出野生型和被修饰位点的 PCR 产物长度差异。产物是与修饰后位点长度一致的单一条带,说明所有的拷贝都被修饰。如果出现两条产物条带,一条匹配野生型一条匹配修饰后位点,说明至少一个等位基因仍未被修饰。Southern blotting 同样可以在这种实验中用来排除随机整合。
答:我们的 TAL 效应子或 CRISPR 载体是设计成不会宿主体内复制或整合到宿主基因组的类型。这些质粒被瞬时转染后,通常会在几轮细胞分裂后丢失,不会进一步影响宿主细胞。在转染后,细胞被低密度涂布,促进单克隆群落的生成。这些群落应进行检测,确保质粒已经丢失。检测可以采取抗性筛选的方法,观察细胞是否对质粒抗性基因对应的抗生素敏感;或者观察质粒的荧光报告基因是否不再表达。我们建议使用 mRNA 而不是 DNA 进行转染,来确保转染的瞬时性。
答:能。TALEN 和 CRISPR 都有同时编辑多个拷贝的能力。编辑的效率受到不同因素影响,如细胞类型、转染效率和 CRISPR/TALEN 的活性。
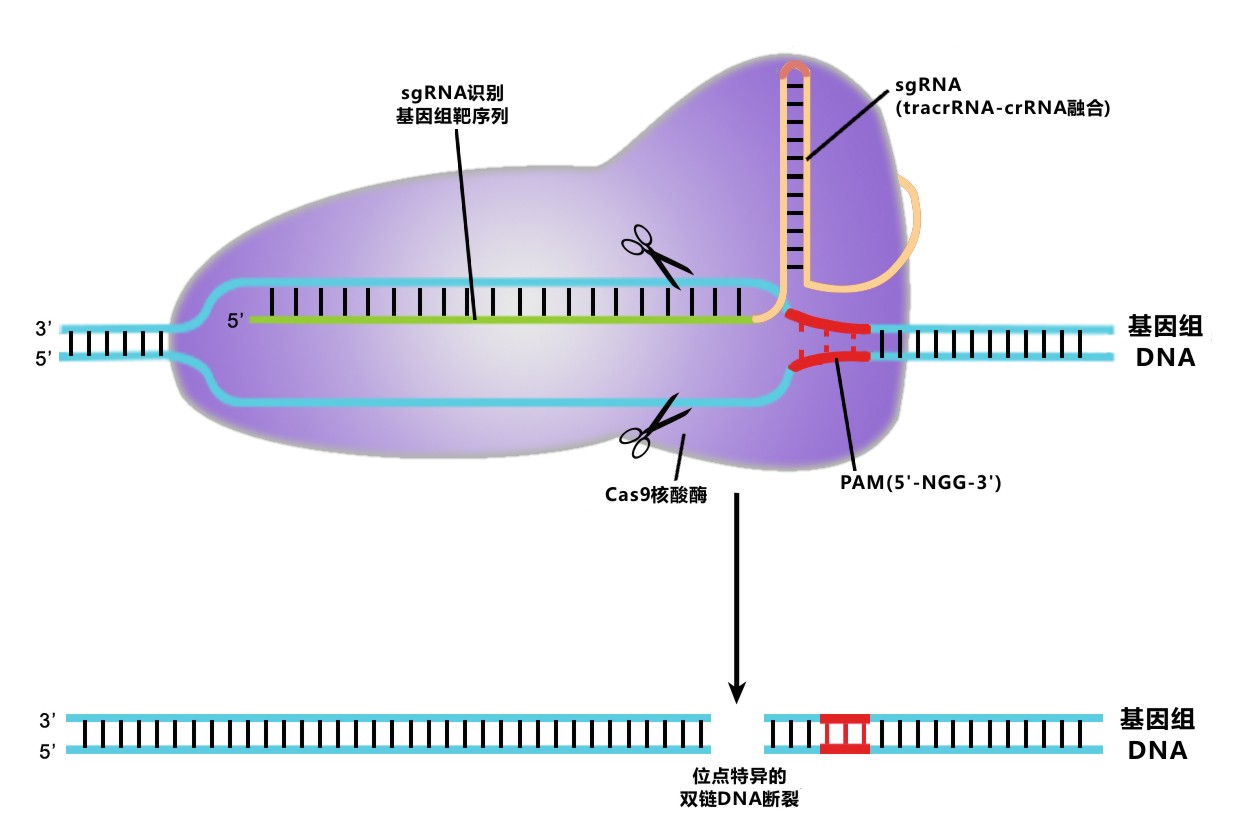
答:TAL 效应子与 CRISPR 都能识别特定靶点序列来进行基因组编辑操作。它们之间最大的不同是实现识别与编辑的方式。CRISPR 通过一段 sgRNA 识别长约 20 个碱基的靶点序列。这段靶点序列末端必须紧接有 N-G-G (PAM)序列。sgRNA 引导 Cas9 核酸酶剪切靶点。当使用 CRISPR 体系时,我们需要进行设计的是 sgRNA 的序列。
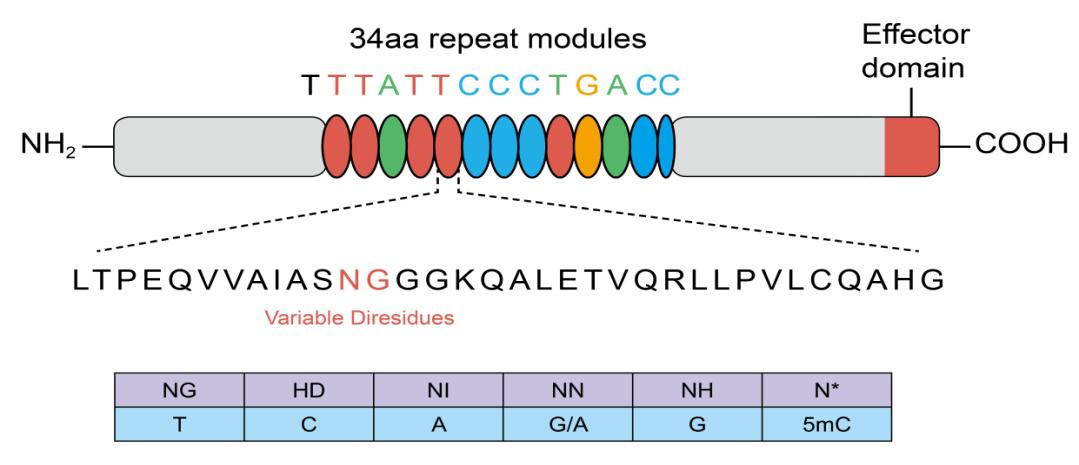
TAL 效应子由长约 34 个氨基酸的蛋白模块串联组成。这些蛋白模块的氨基酸序列高度保守,除了第12,13位氨基酸可变,通过这两位氨基酸残基对靶序列进行识别。一种蛋白模块特异识别一种碱基。
TAL 效应子可以与功能域(如核酸酶或转录调控因子)融合进行靶向的基因组编辑。在使用 TAL 效应子技术时,我们需要以正确的顺序组合蛋白模块来匹配靶点序列。
答:视乎您的实验目的和需要。TALEN 和 CRISPR 体系各有各的优缺点。CRISPR 体系编辑基因的效率一般要高于 TALEN,且 CRISPR 对甲基化不敏感,更适用于多靶点编辑,这些方面对比 TALEN 优势确实相当明显。但另一方面,CRISPR,包括 Cas9 切口酶在内,都更容易有脱靶效应。视乎实验目的,这对于某些实验应用来说是个影响较大的问题。
TALE
CRISPR
答:Yes. 可以。我们也提供 Cas9 D10A 切口酶的表达克隆,也成功测试过双切口酶方法。要使用切口酶生成 DNA 双链断裂(DSB),需要使两条间距恰当的 sgRNA 正确地分别靶向断裂位点两侧的双链。此外,sgRNA 针对的靶点序列3端需要紧接有“N-G-G” PAM 序列,因此,不是每个位点的序列都合适双切口酶方法。
答:可以。要使用切口酶生成 DNA 双链断裂(DSB),需要使两条间距恰当的 sgRNA 正确地分别靶向断裂位点两侧的双链。生成的 DSB 足够诱导靶点与供体克隆之间发生同源重组(HR)。这个方法好处是降低潜在的脱靶效应(脱靶造成的单链切口基本能被修复,不会诱发非同源末端链接引起插入确实突变),但并非没有限制。sgRNA 针对的靶点序列3端需要紧接有“N-G-G” PAM 序列,因此,不是每个位点的序列都合适双切口酶方法。
答:我们只提供装载好客户定制的 sgRNA 的 CRISPR 质粒。如果您需要阴性对照,我们可以提供装有乱序 sgRNA 的 CRISPR 克隆。
答:能。
答:能。Cas9 有一种双位点突变体完全不带有核酸酶活性。这种突变体可以与一个转录调控因子(如VP64)融合,靶向特定的基因。您可以使用这种失活的 Cas9 和设计好的 sgRNA 配合用于抑制或干扰基因的转录。
答:可以。我们有非慢病毒型和慢病毒型两种载体。我们也提供慢病毒颗粒包装服务,为您提供表达 Cas9 和 sgRNA 的慢病毒颗粒。
答:很遗憾,这个方法对同源重组(HR)行不通。慢病毒以 RNA 的形式进入细胞,但 HR 的供体克隆需要以 DNA 的形式与 Cas9 及 sgRNA 同时进入细胞。
Safe Harbor
答:可以。易锦提供 TALEN 型和 CRISPR 型的 Safe Harbor 试剂盒,可以靶向人类 AAVS1 位点或者小鼠 ROSA26 位点。这些试剂盒能完全兼容我们的 Safe Harbor ORF 敲入克隆。
sgRNA 文库
答:我们提供慢病毒颗粒、转染级质粒 DNA 以及菌种型的混合文库。
答:有。目前我们提供的标准文库都是混合文库,但如果您希望获得单独克隆的阵列文库,联系我们获取报价即可。
答:可以。不过我们强烈建议您先建立一个可以稳定表达 Cas9 的细胞系,这样能最大限度确保文库的每个 sgRNA 表现度的一致性。可以先将您的 Cas9 慢病毒克隆转导到您的细胞。一旦你建立起稳定表达 Cas9 的细胞系,再使用 sgRNA 文库进行转导。
答:可以。我们慢病毒质粒是两用的,既可以用来包装慢病毒颗粒,也可以通过标准转染方法转染细胞。
答:在使用混合文库时,要完全确保每细胞只被 1 条 sgRNA 感染、或者单细胞被文库所有的 sgRNA 感染都是不可能的。但我们目前提供的文库规模都不大,因此如果被感染的细胞总数达到 100 × 文库的 sgRNA 数,那您应当能获得接近完全的表现率。